据 11 月 30 日发布的《国家药监局关于实施药品注册申请电子申报的公告(2022年 第110号)》显示,自 2023 年 1 月 1 日起,申请人提交的国家药监局审评审批的药品注册申请以及审评过程中补充资料等,调整为以电子形式提交申报资料,申请人无需提交纸质申报资料。申请人应当按照现行法规及电子申报资料要求准备电子申报资料,将光盘提交至国家药监局药品审评中心提出申请。申请人采用药品电子通用技术文档(eCTD)进行申报的,无需再提交纸质申报资料,其他要求仍需按照《关于实施药品电子通用技术文档申报的公告》(2021年第119号)执行。
这一电子提交法规政策的落地,对于中国药品注册文件递交无疑是里程碑式的节点,引起了医药行业人士的广泛关注。
我们纵观美国 FDA 的 eCTD 发展史,FDA 注册资料的递交也是经过了逐步迭代最终发展成为电子通用技术文件(eCTD)。实施 eCTD,一方面提升了监管部门对药品的监管能力,以及能更便捷地进行申报资料检索验证,评审员可以很容易找到和获得他们需要审查的信息,无论是原始数据还是后来补充的资料;另一方面对于制药企业的国际化、全球化发展进程来说,首先企业内部通过使用 eCTD 结构能对药品申报资料进行更细化的管理,尤其是在企业多中心的临床试验阶段,使用 eCTD 格式更方便了临床研发过程中数据及时汇总,以及进行研究报告的输出等等,全面提升了药品整体申报效率;另外,制药企业在进行国际化注册时,例如进入中国进行进口药品注册申报时,申报资料不需要进行二次变化,因为在中国使用 eCTD 电子递交格式与全球其他实施 eCTD 的国家药品监管机构使用的格式相同。
众所周知,eCTD 格式包含一个电子目录,也被称为主干,管理着一个应用程序的所有元数据。这个主干被分解成五个模块,文件被适当放置在模块中,以 CTD 三角的形式呈现。
模块1指代区域信息,如表格、封面信、标签和调查手册;
模块2指代摘要,如CMC、临床和非临床摘要;
模块3指代质量(CMC)信息;
模块4指代非临床信息;
模块5指代临床信息;
每个模块涵盖不同的申报内容,且有明确的层级结构,通过结构化的目录,可快速查找和定位申报资料的不同内容,从药学研究到临床试验,整套 eCTD 文件可以了解药品研发的全过程。
随着中国 NMPA 关于电子递交政策的落地,医药行业会顺势努力满足监管和法规要求,作为一家成立超过 20 年的翻译行业中的医学翻译领导者——北京康茂峰科技有限公司,以药品注册申报资料翻译见长,公司在软、硬件技术工具配备上一直走在行业前列,无论是 Trados CAT 翻译辅助系统、先进的 Plunet 翻译项目管理系统、译文质量审校评估 LQR 系统等等。以技术为驱动,快速的市场反应能力,一直是康茂峰能够引领医学翻译行业的重要优势。
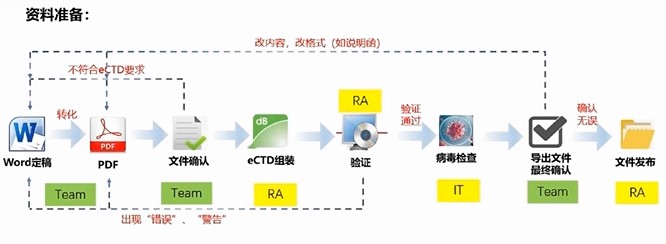
据悉,康茂峰早在 2018 年就打造了一支技术精湛的 eCTD 技术服务团队,成功协助多家中国制药企业完成美国 FDA 的注册申报资料 eCTD 格式递交中的翻译与文档排版工作,对于 eCTD 电子递交初期的文档制作了熟于心。
例如,eCTD 格式中的 Word 文档格式调整,康茂峰排版校对人员能快速完成符合中英 CTD 体例要求、撰写界面和操作规范、标题序号快速指定、常用符号快捷使用、纵向/横向表格/图制作、多种目录自动生成等工作;对于 eCTD 格式中的 PDF 文件制作,可自动设置 Word 文档批量值、PDF 属性值以及合规的缩放比率,便捷的书签和链接制作以及书签和链接批量 OCR 识别等等。康茂峰 eCTD 技术服务团队从源头上规范申报文档撰写格式等问题。
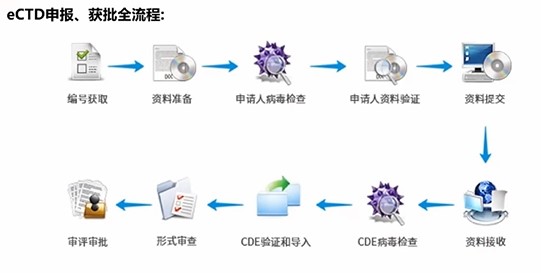
目前我国药监局对于 eCTD 格式的注册资料还处于光盘提交阶段,全球范围内已有越来越多的监管机构支持通过专用网络通道进行提交,因而采用 eCTD 申报则是中国朝着国际统一迈进的必然之举。广大制药企业 RA 们既要吃透药品注册法规,又要研究透 eCTD 格式繁杂的框架系统,无疑会需要极大的资源与时间上的投入。
康茂峰早在政策发布前就意识到电子申报是行业的大势所趋,历时数月的多方调研与试验,于本月成功配备了符合 ICH 和中国 NMPA 要求的全生命周期管理的 eCTD 电子递交系统,可为制药企业提供一整套建立、审阅、验证和发布全流程 eCTD 电子提交解决方案。康茂峰的 eCTD 电子递交系统严格遵循 CTD 规范,支持多人团队协作,实时在线编辑和保存,通过系统合规性提示,帮助技术人员避免错误操作,保障申报过程完全合规,可直接应用于 CDE 的 eCTD 电子申报,助力广大制药企业轻松、快速地实现全球范围内的电子申报。
