众所周知,药品注册资料涉及安全性、药学、临床等方面的内容,作为专业的医学翻译,译员首先要了解注册申报资料中常用的词汇和语言表达习惯;其次,了解药品注册法规和熟悉药典也是非常有必要的。在全套药品注册资料中,CMC 药学资料是新药申报中非常重要的模块,包括原料药模块,制剂模块,辅料的控制等内容。
今天,康茂峰医学翻译跟大家分享一下中国药典中对辅料凝胶剂(Gel)的介绍。
凝胶剂(Gel)是指药物与能形成凝胶的辅料制成均一、混悬或乳状液形的稠厚液体或半固体制剂。能形成凝胶的辅料有泊洛沙姆(Poloxamer)、依地酸二钠(EDTA Disodium)、多库酯钠(Docusate sodium)、丙二醇(Propylene glycol)。像我们常见的凝胶药品有甲硝唑凝胶(Metronidazole Gel)、他扎罗汀凝胶(Tazarotene Gel)、对乙酰氨基酚凝胶(Paracetamol Gel)、异维A 酸凝胶(lsotretinoin Gel)、过氧苯甲酰凝胶(Benzoyl Peroxide Gel)等等。
中国药典2020年版第四部通则0114凝胶剂中对凝胶剂的生产与贮藏期间有以下规定:
一、胶剂中胶粒应分散均匀,不应下沉、结块。
二、凝胶剂应均匀、细腻,在常温时保持胶状,不干涸或液化。
三、根据需要,凝胶剂中可加人保湿剂、抑菌剂、抗氧剂、乳化剂、增稠剂和透皮促进剂等。除另有规定外,在制剂确定处方时,该处方的抑菌效力应符合抑菌效力检查法(通则1121)的规定。
四、凝胶剂一般应检查pH值。
五、除另有规定外,凝胶剂应避光、密闭贮存,并应防冻。
六、凝胶剂作为无菌制剂时,应进行无菌检查;作为非无菌制剂时,应进行非无菌检查。
除另有规定外,凝胶剂还应进行以下相应检查。
粒度:检查法为取供试品适量,置于载玻片上,涂成薄层,薄层面积相当于盖玻片面积,共涂3片,照粒度和粒度分布测定法(通则0982第一法)测定,均不得检出大于180 μm的粒子。
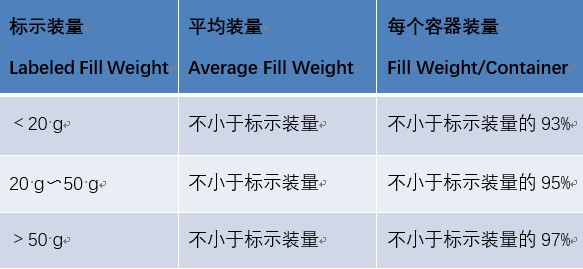
装量:照最低装量检查法(通则0942)检查,可采用重量法(适用于标示装量以重量计的制剂),除另有规定外,取供试品5个(50 g以上者3个),除去外盖和标签,容器外壁用适宜的方法清洁并干燥,精密称定重量,除去内容物,容器用适宜的溶剂洗净并干燥,再精密称定空容器的重量,求出每个容器内容物的装量与平均装量,均应符合下表的有关规定。如有1个容器装量不符合规定,则另取5个(50 g以上者3个)复试,应全部符合规定。